1. 리튬이온 배터리
1.1. 생활 주변 배터리들
현재 우리 주위에서 쓰는 거의 모든 배터리는 리튬이온 배터리이다. 최근에는 스마트폰이 배터리 일체형이 대부분이라 배터리의 모습은 거의 보기 힘들게 되었지만 모바일 기기에는 필수적으로 배터리가 들어가 있어야 하고 이것이 충방전이 가능한 이차전지이면 대부분 리튬이온 배터리이다. 리튬이온 배터리와 다른 종류의 배터리를 찾아보면, 내연 자동차에 쓰이는 배터리는 납축전지가 들어가 있다. 전기차에도 여전히 기존 12V 전자 장치 작동을 위해 납축전지가 들어간다. 이차전지는 한 번 쓰고 버리는 1차전지와 달리 방전후 충전이 가능하고 여러 번 재사용이 가능한 전지를 말한다. 사용빈도가 높고 사용시간이 긴 전자장치는 대부분 이차전지를 사용한다. 대표적인 기기가 전동공구, 면도기 배터리는 니카드 배터리에서 최근 리튬이온 배터리로 많이 변경이 되고 있다. 니카드 전지 (nickel-cadmium battery)는 양극에 니켈의 수산화물을, 음극에 카드뮴을 사용한 알칼리 축전지이다. 약 1.2 볼트의 방전 전압을 가지며 방전이 끝날 때까지 거의 감소하지 않는다. 니카드 전지 다음으로 니켈-수소 배터리도 있다. 음극을 카드뮴 대신 수소 합금을 사용한다. NiMH 배터리는 동일한 크기의 NiCd 용량의 2 ~ 3배를 가질 수 있어 에너지 밀도는 리튬이온 배터리와 비슷한 수준이다. 우리 주위에 다양한 배터리들이 있지만 최근에 가격만 맞으면 리튬이온 배터리로 교체하려는 추세가 강한 상황이다.
1.2. 리튬이 선택된 이유?
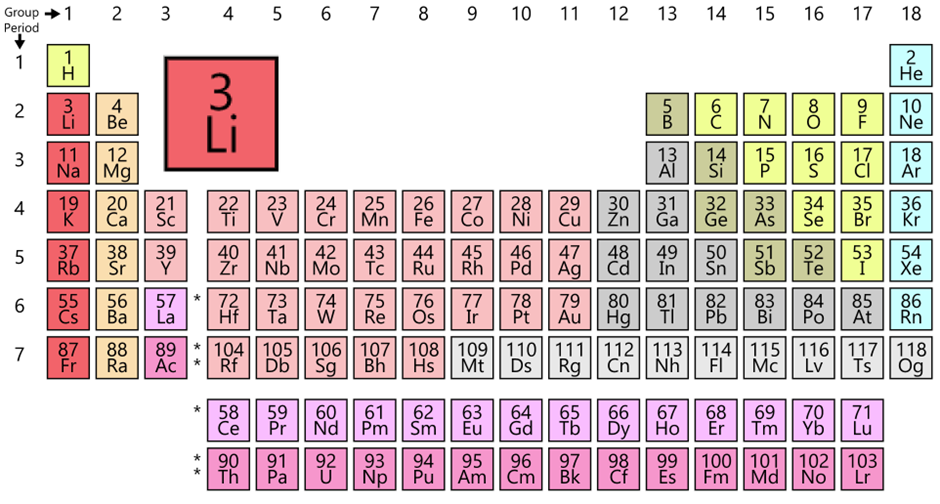
이름에 리튬이온이 들어가 있는 것으로 보면 배터리에서 리튬의 역할이 매우 중요하다는 것을 알 수 있다. 배터리 이름에 니켈, 카드뮴, 망간, 수소 등의 원소들이 언급되었는데 결국 리튬이 선택되었다는 것은 리튬만이 가지고 있는 어떤 성질 때문일 것이다. 리튬은 주기율표 1그룹에 속하는 원소로 알칼리 금속의 특징을 가지고 있고 이 특징은 리튬이온 배터리 기본 성질의 바탕이 된다.
[그림] 원소 줄기율표 (출처 : 위키피디아[우1] )
[우1]https://en.wikipedia.org/wiki/File:Simple_Periodic_Table_Chart-en.svg
알칼리(Alkali) 금속은 주기율표 1족에 속하는 원소로 수소를 제외한 리튬(Li), 소듐(Na), 포타슘(K), 루비듐(Rb), 세슘(Cs), 프랑슘(Fr)의 6개 원소를 일컫는다. 반응성이 매우 강해서 공기 중의 산소와 반응하여 산화물을 형성하고 그 과정에서 금속 광택을 잃는다. 물과 반응하여 수소 발생 및 수산화물을 형성하여 강한 염기성을 보이는 것에서 알칼리 금속이라는 명칭이 유래하였다. 여러 비금속 원소와 반응하며 특히 할로겐(Halogen)과 직접 반응하여 염(Salt)을 형성하고 수소와 반응하면 수소화합물을 형성한다. 알칼리 금속은 원자의 전자가 1개이고 전자 1개를 잃고 양이온이 되기 쉽다. 같은 주기에서 다른 족 원소들과 비교하면 상대적으로 원자 반지름은 큰 편이며, 이온화 에너지는 작으므로 산화되기 쉬운 성질을 가진다. 이러한 특성으로 인해서 알칼리 금속은 표준 환원 전위 값이 매우 큰 음의 값을 가지고 있다.
리튬이온 배터리의 기본 동작은 리튬의 이온화 특성이다. 이온화 경향은 금속이 전자를 내주고 플러스 이온이 되려고 하는 정도이다.
* 금속이온화 경향 : Li>K>Ca>Na>Mg>Al>Zn>Sn>Pb>(H)>Cu>Hg>Ag>Au(금)
금이 가장 낮고 리튬이 가장 높다. 이런 높은 이온화 경향 때문에 리튬이 배터리 소재로 선택이 된 것이다. 리튬, 나트륨 금속은 자연계에서 탄산리튬, 염화나트륨 상태로 존재하지 순수한 금속으로는 존재하기가 어렵다. 금을 보면 가장 이해가 쉽다. 금은 이온화 경향이 가장 낮기 때문에 수천년 지하에 묻혀도 온전한 상태로 발굴이 되는 것이다. 주기율표 상에 리튬 밑에 나트륨이 있고 나트륨은 리튬과 비슷한 성질을 가지고 있다. 리튬보다는 구하기 쉬운 금속이므로 최근 차세대 배터리로 나트륨 전지가 활발히 연구되고 있다.
왜 전자와 리튬은 이런 방향으로 이동을 할까? 직류 전류는 양극에서 음극으로 흐르고 전자는 음극에서 양극으로 반대로 흐른다. 따라서 전기가 필요한 장치에 전지를 연결하면 전지 내부에서는 자발적인 화학 반응인 방전이 시작이 된다. 이때 - 극에서는 리튬 금속이 산화되어 리튬이온이 생성되는 산하 반응이 자발적으로 일어나게 된다. 충전 동작도 전기가 공급이 되면 리튬이온의 이온화 경향 때문에 먼저 이온화가 되고 전자는 전류 반대방향으로 음극으로 이동하고 다시 음극에서 리튬이온과 전자가 결합하게 된다. 양극재 LCO(Li2CO2)를 예로 들면 식과 같이 표현된다.
양극 LCO에서 반응식 :

음극 흑연에서 반응식 :

간단히 정리하면 양극에서 전자가 나오고 리튬이온이 음극으로 이동하여 흑연과 결합한다는 것이다. 화학전지에서는 양극을 Cathode 라고 하고 여기에 들어가는 소재를 양극재 또는 양극활물질 라고 한다. 음극은 Anode 라고 하고 여기에 들어가는 소재를 음극재 또는 음극활물질 라고 한다. 현재 대표적인 음극재는 흑연(Graphite)이다.
'리튬이온 배터리 산업편' 카테고리의 다른 글
| 이차전지 K배터리 산업 : 배터리 4대 구성 : 양극재, 음극재, 분리막, 전해질 (0) | 2024.12.01 |
|---|---|
| 이차전지 K배터리 산업 : 배터리 기본 동작, 어떻게 동작하나? (0) | 2024.12.01 |
| 이차전지 K배터리 산업 : 배터리 차세대 원재료 (0) | 2024.12.01 |
| 이차전지 K배터리 산업 : 배터리 원소재들 리튬 니켈 코발트 (1) | 2024.12.01 |
| 이차전지 K배터리 산업 : 2019년 노벨 화학상 ‘리튬이온 배터리 개발 역사’ 존 구디너프, 스탠리 휘팅엄, 요시노 아키라 (1) | 2024.12.01 |




